3A - TC e 3B - TC ; ALTERNANZA SCUOLA - LAVORO
Argomento trattato: IL LATTE
Per scaricare tutti i gli argomenti trattati ( fotocopie , video, animazioni ecc.) cliccare su QUESTO LINK ed inoltre cliccare su FOTO per le immagini relative alla attività svolta.
Sotto un video che illustra come dal latte si ricava il formaggio
Ulteriori descrizioni su come si fa il formaggio si possono ottenere da questo sito: http://www.formaggio.it/come-si-fa-il-formaggio/ nella sezione "formaggio a coagulazione presamica" e "formaggio a coagulazione acida".
Controllo chimico - fisico del latte
Determinazione del peso specifico del latte
Tali valori risultano superiori in caso di latte scremato, inferiori in caso di latte annacquato. Per altro se la scrematura e l’annacquamento vengono effettuati sullo stesso prodotto, nell’ambito di un 10%, non si verificano variazioni del peso specifico. In tale circostanza sono le analisi del peso specifico del siero, della % di materia grassa e dell’indice crioscopico a rivelare la sofisticazione.
Per la determinazione si utilizza uno speciale areometro, il LATTODENSIMETRO DI QUEVENNE, un’asta di vetro contenente ad un’estremità della zavorra ed all’altra estremità una scala graduata in 29 tacche, comprese tra 14 e 42: le due cifre indicano la seconda e la terza decimale, quindi si deve anteporre ad esse 1,0. Nell'immagine accanto il valore del peso specifico del latte campione è 1,035. Lo strumento incorpora un termometro ed è tarato a 15°C.
Il peso specifico del latte è in relazione sia alle sostanze in soluzione ed in sospensione (acqua e residuo magro) sia alle sostanze in emulsione (grassi). La determinazione è basata sul Principio di Archimede: un corpo galleggiante (areometro) si immerge nel latte fino a quando il peso del liquido spostato equivale al peso dell’areometro.
| Lattodensimetro di Quevenne | |
| Cilindro da 300 ml |
| Mescolare il latte per renderlo omogeneo capovolgendo o agitando il contenitore | |
| Versarlo lungo le pareti del cilindro fino a circa 10 cm dal bordo, evitando la formazione di schiuma | |
| Introdurre con cautela il lattodensimetro, senza farlo aderire alle pareti | |
| Dopo circa 1 minuto leggere il numero che risulta all’affioramento dell’asta graduata del lattodensimetro (se si legge per esempio 31, significa che il peso specifico del latte è 1,031) | |
| Leggere la temperatura del latte sul termometro incorporato: se questa è diversa da 15°C, ma comunque compresa tra 10 e 20 °C, occorre effettuare un calcolo correttivo che consiste nell’aggiungere o togliere al valore letto 0,0002 per ogni grado di temperatura rispettivamente superiore o inferiore a 15°C. |
CALCOLO CORRETTIVO : ps 15°C = pst° + 0,0002 ( t - 15 )
Determinazione della percentuale di grasso presente nel latte con il metodo di Gerber
Questo metodo è il più usato per determinare il grasso nel latte. Esso si basa sul fatto che un miscuglio di Acido Solforico ( d=1,82 mg/ml ) e di Alcool Amilico è capace di disciogliere tutti i componenti del latte tranne il grasso. Compiendo l'operazione in un apparecchio adatto il grasso si raccoglie nello strato superiore del miscuglio agevolando la sua completa separazione mediante riscaldamento e centrifugazione.
La quantità di grasso contenuta nel latte non trattato varia tra i 2,5 al 4,5 %.
Per il latte parzialmente scremato non deve essere inferiore all'1% e non superiore all'1,8 %.
VIDEO SULLA DETERMINAZIONE DEI GRASSI
La metodica per la determinazione dei grassi nel latte con il metodo di Gerber la si può scaricare QUI.
A sinistra - le varie fasi della determinazione della densità del latte durante una esercitazione della 3°B - tc del San Benedetto di Latina
A destra le varie fasi della determinazione delle ceneri di un campione di latte
Determinazione della acidità di un latte
Per determinare lo stato di freschezza di un latte si può determinare il suo grado di acidità.
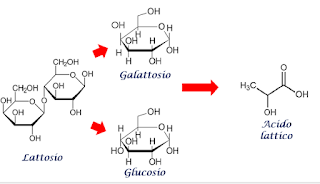
Il latte infatti, per opera di alcuni microrganismi normalmente presenti, tende con il tempo a diventare acido. Più precisamente alcuni microrganismi attaccano il lattosio, zucchero presente nel latte, è lo trasformano in acido lattico.
La crescente presenza dell'acido lattico fa diminuire il ph dello stesso fino a farlo diventare addirittura imbevibile.Per determinare l'acidità di un latte si possono utilizzare due metodi. Il primo dei due, esposto nel video sottostante, va a determinare la percentuale di acido lattico presente, Se supera lo 0,18 % non è da considerarsi fresco.
Per scaricare tale metodica cliccare su QUESTO LINK.
La crescente presenza dell'acido lattico fa diminuire il ph dello stesso fino a farlo diventare addirittura imbevibile.Per determinare l'acidità di un latte si possono utilizzare due metodi. Il primo dei due, esposto nel video sottostante, va a determinare la percentuale di acido lattico presente, Se supera lo 0,18 % non è da considerarsi fresco.
Per scaricare tale metodica cliccare su QUESTO LINK.
Nel secondo metodo, chiamato metodo dei gradi di SH si va a verificare quanti ml di soluzione acquosa di NaOH 0,25 N servono per neutralizzare l'acidità di 100 ml di latte. Per un latte non alterato si ha un valore di NaOH che non supera gli 8 ml (SH); valori maggiori indicano che il latte è troppo acido e quindi non fresco.Per sacricare la metodica che utilizza i gradi SH cliccare su QUESTO LINK n. 2
DETERMINAZIONE DELLA ACIDITÀ DI UN LATTE MEDIANTE LA DETERMINAZIONE DELLA % m/V DI ACIDO LATTICO PRESENTE
Determinazione
delle proteine del latte con il metodo di Steinegger
La
determinazione delle proteine del latte rigorosamente si effettua con
il metodo di Kjeldahl. Tale metodo è però un po' laborioso per cui
se non si vuole un alto grado di accuratezza conviene usare il metodo
di Steinegger qui esposto. Tale metodo è più veloce.
Il
metodo si basa sul fatto che una volta neutralizzata la normale
acidità di 100 ml latte dovuta alla presenza dell'acido lattico si
fanno reagire successivamente le proteine nel latte con aldeide
formica ( reazione di Schiff).
Cliccare sull'immagine per ingrandirla.
Tale reazione blocca la funzione amminica delle proteine che interferirebbe in una eventuale titolazione acido - base con NaOH e trasformano di fatto la molecola della proteina in una molecola di un acido carbossilico per la presenza del gruppo -COOH .
Infatti facendo preventivamente reagire le proteine con aldeide formica si ha la formazione di aldimmine nelle quali la funzione carbossilica acida delle proteine è libera senza interferenze da parte della funzione amminica oramai bloccata e trasformata in aldimmina.
Tale
funzione carbossilica libera produce una acidità proporzionale al
tenore delle proteine presenti.
Neutralizzando
tale acidità con NaOH 0,25 N si consumano alcuni millilitri di tale
soluzione. Moltiplicando il valore dei ml utilizzati per un fattore
numerico sperimentale ( 0,485) si ottiene il valore in % m/v delle proteine
presenti.
Se si viuole conoscere la % delle sole caseine presenti nel latte il valore dei ml utilizzati va moltiplicato per 0,375.
Per scaricare la metodica di di tale analisi cliccare su QUESTO LINKSe si viuole conoscere la % delle sole caseine presenti nel latte il valore dei ml utilizzati va moltiplicato per 0,375.
LA
DETERMINAZIONE DEL LATTOSIO PRESENTE NEL LATTE
La
determinazione del lattosio presente nel latte si esegue sul siero
del latte ovvero sulla parte acquosa del latte priva di grassi e
proteine.
Per
ottenere il siero un campione di latte viene trattato con acido
acetico glaciale, si diluisce e si effettua una filtrazione per
eliminare i grassi e le proteine.
Il
filtrato, ancora opportunamente diluito (complessivamente 1:5 ),
contiene il lattosio da titolare che essendo uno ZUCCHERO RIDUCENTE può essere ossidato da un blando agente ossidante.
Come
agente ossidante si utilizza il reattivo di Fehling.
Il
reattivo di Fehling è costituito da 2 soluzioni. La prima è
costituita da 5 ml di soluzione acquosa di solfato di rame
pentaidrato, la seconda da 5 ml di soluzione acquosa di tartrato di
sodio o potassio in soluzione acquosa alcalina per la presenza di
NaOH. Vedere in QUESTO LINK la esatta costituzione di tale
reattivo.
Le
due soluzioni al momento dell'uso vanno unite formando così una
unica soluzione di 10 ml di colore azzurro per la presenza dello ione
Cu++ che rimane in soluzione senza precipitare come
idrossido perché complessato dal tartrato.
In
una buretta graduata si introduce la soluzione del siero contenete
la quantità di zucchero da determinare, mentre il reattivo di
Fehling si introduce in una beuta sottostante, sottoponendo tale
soluzione al riscaldamento fino all'ebollizione. Si procede così alla titolazione a
caldo.
Durante
la titolazione il rame Cu++ ossida il lattosio e lo
trasforma in acido carbossilico mentre il rame si riduce a ione Cu+.
Tale ione non complessato dal tartrato precipita in seguito come
ossido rameoso Cu2O di colore rosso mattone.


Durante
tale operazione il colore azzurro della soluzione si attenua fino a
diventare incolore a causa del consumo dello ione rameico ( Cu++
). Quando avviene ciò significa che si è arrivati al punto
equivalente. Ovvero tutto il Cu++ del reattivo di
Fehling è stato consumato e ridotto dal lattosio. Tale operazione
fino qui va condotta con una certa rapidità.
Per poter apprezzare meglio il punto finale della titolazione durante la titolazione si possono aggiungere alcune gocce di una soluzione di blu di metilene all 1% come indicatore ossido riduttivo.
Dopo questa aggiunta,la soluzione contenuta nella beuta, che viene mantenuta all'ebollizione, assume un colore verdastro come conseguenza del miscuglio di due colori: il blu dell'indicatore e del rame ancora complessato dal tartrato ed il rosso del Cu2O formato.
Quando tutto il rame è stato ridotto, cioè al punto di equivalenza, il lattosio contenuto nella prima goccia in eccesso di siero riduce il blu di metilene in un composto incolore e quindi il colore vira dal verdastro al rosso vivo.
Se
si attende qualche secondo si nota che la soluzione diventa di colore
rosso mattone per il successivo formarsi dell'ossido rameoso.
.
Arrivati
alla equivalenza si leggono sulla buretta i ml di siero utilizzati e
si procede ai calcoli.
Per
procedere ai calcoli si utilizza tale formula :
In
tale formula A sono i ml di siero utilizzati per raggiungere
l'equivalenza.
Tale
formula nasce da una considerazione sperimentale frutto di una serie
di analisi fatte dagli analisti e cioè che il reattivo di fehling
( 5 ml di soluzione A + 5 ml di soluzione B) consuma esattamente
0,0676 g di lattosio.
Quindi
quando si è arrivati all'equivalenza utilizzando A ml di siero
significa che in tali A ml vi erano 0,0676 g di lattosio.
Dividendo
0,0676 g per A ml si ottiene la quantità di lattosio presente in 1
ml di siero. Tale siero però era stato diluito nel nostro caso in
un rapporto 1: 5 per cui per tornare alla sua concentrazione
originale di lattosio bisogna moltiplicare per 5, quindi si ha:
Se
si moltiplica il risultato di sopra per 100 si ha la % m/v di
lattosio nel latte campione che può essere considerata uguale alla
% m/M.
Per
visionare o scaricare la metodica di tale analisi contenente i
dettagli operativi cliccare su QUESTO LINK.
Il lattosio può essere determinato anche per via polarimetrica. Per avere notizie in merito a tale metodo cliccare QUA
Il lattosio può essere determinato anche per via polarimetrica. Per avere notizie in merito a tale metodo cliccare QUA
Determinazione dei
cloruri nel latte
Il tenore dei
cloruri nel latte espresso in cloruro di sodio normalmente varia da
1,55 g/litro a 1,75 g/litro.
L'annacquamento del
latte produce una diminuzione della loro concentrazione nel latte per
cui i frodatori vi aggiungono acqua salata.
Si può osservare
anche il rapporto tra il cloruro di sodio e il lattosio ovvero:
che normalmente è
inferiore a 4,1. In una frode ottenuta aggiungendo acqua salata tale valore aumenta.
Anche malattie della
mammella dell'animale portano però a risultati superiori a tale
valore.
Nel latte e derivati
(yogurt) la determinazione si può eseguire con il metodo di Volhard o con il metodo di Mohr
Cliccando QUI è possibile visionare e scaricare la metodica con il metodo di Mohr
Cliccando su QUESTO LINK si può visionare un video riguardante il metodo di Volhard
e cliccando su QUESTO DOCUMENTO è possibile scaricare la metodica del metodo di Volhard con le opportune spiegazioni.
.
Cliccando su QUESTO LINK si può visionare un video riguardante il metodo di Volhard
e cliccando su QUESTO DOCUMENTO è possibile scaricare la metodica del metodo di Volhard con le opportune spiegazioni.
.
Determinazione delle ceneri
Le ceneri del latte sono costituite dall'insieme delle sostanze minerali esistenti nel latte. Normalmente un latte genuino ha un contenuto di ceneri del 0,7 - 0,8 %. Un contenuto superiore fa
sospettare l'aggiunta di carbonati e bicarbonati atti a neutralizzare la eccessiva acidità del latte dovuta
ad un invecchiamento. Un valore più basso fa sospettare l'aggiunta di acqua per aumentarne la quantità.
sospettare l'aggiunta di carbonati e bicarbonati atti a neutralizzare la eccessiva acidità del latte dovuta
ad un invecchiamento. Un valore più basso fa sospettare l'aggiunta di acqua per aumentarne la quantità.
La metodica per la determinazione delle ceneri la si può scaricare QUI.
Determinazione della alcalinità delle ceneri
Un valore di ceneri del latte superiore allo 0,8% fa sospettare una aggiunta nel latte di carbonati e bicarbonati per eliminare l'acidità. Per avere una conferma di tale adulterazione conviene effettuare la determinazione della alcalinità delle ceneri. In sostanza in tale procedura si va a determinare quanto acido solforico 0,1 N si consuma per neutralizzare le ceneri alcaline prodotte da 10 g di latte, Se si supera il valore di 1 ml di acido si ha la conferma della aggiunta di carbonati e bicarbonati,
La metodica per la determinazione della alcalinità delle ceneri la si può scaricare QUA
Se si vogliono eseguire altre analisi è possibile fare riferimento a QUESTE METODICHE elaborate dal I.T.S. A.S. "D'annunzio" di Gorizia.
OLIO di Oliva
Vari tipi di oli di oliva
In commercio si trovano vari oli provenienti dalle olive ma la qualità degli stessi varia di molto a secondo del metodo con cui l'olio è stato estratto dalle olive.
Se nell'etichetta è scritto " OLIO EXTRA VERGINE DI OLIVA" significa che tale prodotto è stato ricavato solo per una prima e unica spremitura meccanica a freddo delle olive. Tale olio è il migliore in assoluto, ha una bassa acidità ( non superiore allo 0,8% di acido oleico) e le molecole dei trigliceridi costituenti l'olio non presentano rilevanti modificazioni. Il prodotto classificato come "OLIO VERGINE DI OLIVA" è un olio ricavato da una seconda spremitura delle olive. Ha una acidità superiore alla precedente ma questa non deve superare una acidità del 2%. In tale olio si cominciano a verificare delle modifiche nelle molecole dei trigliceridi che però rimangono di entità accettabili.
La pasta di olive risultante da queste prime spremiture, chiamata sansa, contiene ancora dell'olio che però non si riesce a estrarlo meccanicamente. Per estrarlo bisogna ricorrere a metodi ben più drastici.
Dal frantoio la sansa viene inviata ad apposite strutture dove subisce molteplici trattamenti chimici e fisici che pero fanno scadere la qualità dell'olio ricavato.
Gli oli provenienti da tali ulteriori trattamenti vengono denominati "RETTIFICATI" e NON possono essere classificati come VERGINI. Subiscono sostanzialmente gli stessi trattamenti che subiscono gli oli di semi che anche per tali motivi sono considerati di qualità inferiore agli oli di oliva vergini.
Per conoscere quali sono i trattamenti che subiscono tali oli cliccare su QUESTO LINK.
ANALISI GASCROMATOGRAFICA DI UN OLIO DI OLIVA
L'olio di oliva è considerato rispetto agli oli di semi un olio di qualità superiore. Oltre ad essere considerato migliore dal punto di vista organolettico, contiene sostanze chimiche di alto valore nutritivo ed inoltre se è di categoria extra vergine non ha subito manipolazioni chimiche e fisiche tipiche invece di un olio di semi. Dato che l'olio di oliva costa di più, una frode spesso praticata è quella di spacciare e vendere per olio di oliva un normale olio di semi o di fare miscele tra i due tipi di oli per poi rivendere la miscela spacciandola per olio di oliva puro.
Gascromatogramma di in olio di oliva ( in alto) e di un olio di semi ( a destra)- cliccare sulle due immagini per ingrandirle. Comparando i due grafici si nota subito che nell'olio di oliva vi è una percentuale di estere dell'acido oleico molto più rilevante che nell'olio di semi dove invece abbonda l'estere dell'acido linoleico.
Determinazione della acidità di un olio di oliva
Per visionare il video su questo argomento cliccare QUA
Per scaricare la metodica sulla determinazione della acidità di un olio cliccare QUI.
Vari tipi di oli di oliva
In commercio si trovano vari oli provenienti dalle olive ma la qualità degli stessi varia di molto a secondo del metodo con cui l'olio è stato estratto dalle olive.
Se nell'etichetta è scritto " OLIO EXTRA VERGINE DI OLIVA" significa che tale prodotto è stato ricavato solo per una prima e unica spremitura meccanica a freddo delle olive. Tale olio è il migliore in assoluto, ha una bassa acidità ( non superiore allo 0,8% di acido oleico) e le molecole dei trigliceridi costituenti l'olio non presentano rilevanti modificazioni. Il prodotto classificato come "OLIO VERGINE DI OLIVA" è un olio ricavato da una seconda spremitura delle olive. Ha una acidità superiore alla precedente ma questa non deve superare una acidità del 2%. In tale olio si cominciano a verificare delle modifiche nelle molecole dei trigliceridi che però rimangono di entità accettabili.
La pasta di olive risultante da queste prime spremiture, chiamata sansa, contiene ancora dell'olio che però non si riesce a estrarlo meccanicamente. Per estrarlo bisogna ricorrere a metodi ben più drastici.
Dal frantoio la sansa viene inviata ad apposite strutture dove subisce molteplici trattamenti chimici e fisici che pero fanno scadere la qualità dell'olio ricavato.
Gli oli provenienti da tali ulteriori trattamenti vengono denominati "RETTIFICATI" e NON possono essere classificati come VERGINI. Subiscono sostanzialmente gli stessi trattamenti che subiscono gli oli di semi che anche per tali motivi sono considerati di qualità inferiore agli oli di oliva vergini.
Per conoscere quali sono i trattamenti che subiscono tali oli cliccare su QUESTO LINK.
ANALISI GASCROMATOGRAFICA DI UN OLIO DI OLIVA
L'olio di oliva è considerato rispetto agli oli di semi un olio di qualità superiore. Oltre ad essere considerato migliore dal punto di vista organolettico, contiene sostanze chimiche di alto valore nutritivo ed inoltre se è di categoria extra vergine non ha subito manipolazioni chimiche e fisiche tipiche invece di un olio di semi. Dato che l'olio di oliva costa di più, una frode spesso praticata è quella di spacciare e vendere per olio di oliva un normale olio di semi o di fare miscele tra i due tipi di oli per poi rivendere la miscela spacciandola per olio di oliva puro.
Per rilevare tale fraudolenta pratica si può ricorrere alla analisi gascromatografica che riesce a svelare grossolane adulterazioni.
In tale analisi il campione di olio viene preventivamente trattato con metilato di potassio per scindere i trigliceridi in glicerina e esteri metilici dei vari acidi grassi ( metilazione dei trigliceridi ) poi gli esteri cosi liberi vengono iniettati in un gascromatografo per determinarli qualitativamente e quantitativamente. Dalle percentuali dei vari esteri degli acidi grassi è possibile riconoscere se un campione d'olio è di oliva o di semi.
In tale analisi il campione di olio viene preventivamente trattato con metilato di potassio per scindere i trigliceridi in glicerina e esteri metilici dei vari acidi grassi ( metilazione dei trigliceridi ) poi gli esteri cosi liberi vengono iniettati in un gascromatografo per determinarli qualitativamente e quantitativamente. Dalle percentuali dei vari esteri degli acidi grassi è possibile riconoscere se un campione d'olio è di oliva o di semi.
Gascromatogramma di in olio di oliva ( in alto) e di un olio di semi ( a destra)- cliccare sulle due immagini per ingrandirle. Comparando i due grafici si nota subito che nell'olio di oliva vi è una percentuale di estere dell'acido oleico molto più rilevante che nell'olio di semi dove invece abbonda l'estere dell'acido linoleico.
ANALISI SPETTROFOTOMETRICA DI UN OLIO DI OLIVA
Stabilito tramite una analisi gas cromatografica che un campione di olio è un olio ricavato da olive, successivamente per accertarsi che tale campione è un olio "extravergine di oliva" o "vergine di oliva" e non contenga oli rettificati, si andrà a eseguire una analisi spettrofotometrica. Un olio che non contiene oli rettificati manifesterà in un intervallo che va da 240 a 340 nm un spettro caratteristico in cui non si denota una eccessiva assorbanza ( vedi figura a sinistra sotto ). Viceversa un olio rettificato o un olio che contiene parti di oli rettificati avrà in tale intervallo di lunghezze d'onda valori evidenti di assorbanza e una tipica gobba intorno a 268 nm. L'entità di tale gobba può essete misurata è costituisce il cosiddetto Delta K può essere calcolato mediante la formula:
Dove K è l'assorbanza condotta alla lunghezza d'onda a fianco riportata di una soluzione di olio campione presente all' 1% m/v in isoottano.
Stabilito tramite una analisi gas cromatografica che un campione di olio è un olio ricavato da olive, successivamente per accertarsi che tale campione è un olio "extravergine di oliva" o "vergine di oliva" e non contenga oli rettificati, si andrà a eseguire una analisi spettrofotometrica. Un olio che non contiene oli rettificati manifesterà in un intervallo che va da 240 a 340 nm un spettro caratteristico in cui non si denota una eccessiva assorbanza ( vedi figura a sinistra sotto ). Viceversa un olio rettificato o un olio che contiene parti di oli rettificati avrà in tale intervallo di lunghezze d'onda valori evidenti di assorbanza e una tipica gobba intorno a 268 nm. L'entità di tale gobba può essete misurata è costituisce il cosiddetto Delta K può essere calcolato mediante la formula:
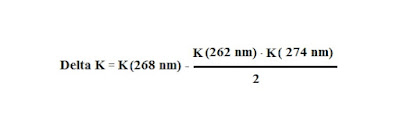 |
Dove K è l'assorbanza condotta alla lunghezza d'onda a fianco riportata di una soluzione di olio campione presente all' 1% m/v in isoottano.
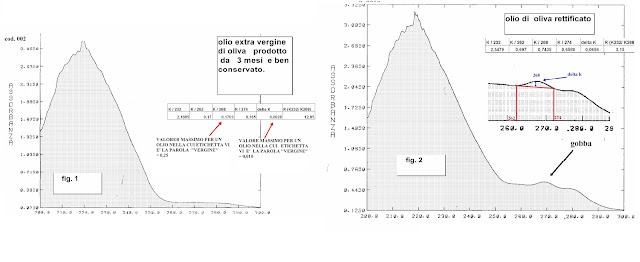
Nella figura di sopra a sinistra si ha un esempio di spettro di un olio extra vergine di oliva. A destra si ha un esempio di un olio contenente olio rettificato. In tale spettro si notano oltre i 240 nm valori evidenti di assorbanza con una caratteristica gobba intorno ai 268 nm. L'innanzamento che subisce la curva in tale lunghezza d'onda costituisce il cosiddetto delta K che può essere calcolato con la formula riportata più sopra.
Per avere altre informazioni, visionare o scaricare la metodica di tale analisi cliccare QUI.
Per avere altre informazioni, visionare o scaricare la metodica di tale analisi cliccare QUI.
L’Acidità
come indicatore di qualità L’acidità
è un parametro che indica la percentuale di acido oleico in un olio
ed è uno
dei
principali
indicatore della qualità. Più alto è il suo valore, più scadente
è la qualità del prodotto. L'acidità è conseguenza diretta del
rilascio degli acidi grassi dovuto al fenomeno dell’idrolisi dei
gliceridi, ed è un parametro qualitativo definibile solo mediante
analisi di laboratorio. È il parametro che consente di valutare le
eventuali alterazioni che le olive e l’olio da esse ricavato
subiscono durante la raccolta, il trasporto e il processo di
trasformazione. Inoltre, la sua valutazione permette la
classificazione merceologica degli oli.
Per visionare il video su questo argomento cliccare QUA
Per scaricare la metodica sulla determinazione della acidità di un olio cliccare QUI.
Se si vogliono approfondire le tematiche riguardanti l'olio con altre analisi, visionare o scaricare
QUESTO DOCUMENTO.
Tale documento è in inglese solo nelle prime due pagine; nelle successive, in italiano fornisce un quadro più completo sulle varie analisi che un olio vegetale può subire per classificarlo.
Tale documento è in inglese solo nelle prime due pagine; nelle successive, in italiano fornisce un quadro più completo sulle varie analisi che un olio vegetale può subire per classificarlo.
ZAFFERANO
La parte del fiore di zafferano che viene utilizzata è costituita dagli stami rossi
Determinazione della categoria merceologica dello zafferano
Se si prelevano gli stami del fiore dello zafferano, si riducono in polvere e successivamente si disciolgono in acqua distillata è possibile mediante misure spettrofotometriche andare a misurare l'assorbanza di tale soluzione a tre specifiche lunghezze d'onda. Tali tre lunghezze d'onda (440,nm, 257 nm e 330 nm) sono relative all'assorbanza di tre principi chimici presenti nello stesso zafferano: la crocina, la picrocrocina e il safranale responsabili in ordine del colore, sapore ed odore dello stesso zafferano.
Utilizzando la relazione A = A1% x C (1)
è possibile dai valori risultanti calcolare A1% delle tre sostanze e classificare all'interno di 4 categorie la qualità dello zafferano stesso.
è possibile dai valori risultanti calcolare A1% delle tre sostanze e classificare all'interno di 4 categorie la qualità dello zafferano stesso.
Ricordiamo che A1% è l' assorbanza ad una specifica lunghezza d'onda scelta, di una soluzione in cui il soluto è presente nella quantità di 1 grammo in 100 ml di soluzione in una cuvetta il cui spessore è 1 cm. A è l'assorbanza misurata dallo strumento ad un specifica lunghezza d'onda, C è la concentrazione della soluzione espressa in grammi su 100 ml di soluzione di zafferano preparata per la misura.
Nella metodica scaricabile più sotto la soluzione preparata per la misura ha una concentrazione di zafferano pari a 0,005 g /100 ml.
Spettro di assorbimento di una soluzione acquosa di zafferano condotta tra 200 e 600 nm.
Osservando lo spettro di assorbimento riportato sopra si vede che il valore di assorbanza relativa alla crocina effettuata a 442,87 nm è pari a 1,1723.
Mediante la formula (1) riportata sopra è possibile calcolare l' assorbanza specifica a ll'1% della crocina che risulta essere di un valore pari a 234 ( A 1% = 1,1723 / 0,005 = 234.).
Tale valore di 234 in base a QUESTA TABELLA merceologica farebbe rientrare tale zafferano in esame nella 1° categoria. Tale operazione va ripetuta anche per gli altri due principi chimici cioè la picrocrocina e il safranale effettuando ulteriori misure dell'assorbanza a 257 e 330 nm.
Se i tre valori risultanti rientrano tutti nella prima riga della tabella possiamo affermare che lo zafferano è di prima categoria (alta qualità).
Qui sotto vi è un video che illustra le varie fasi della coltivazione e di elaborazione dello zafferano.
Spettro di assorbimento di una soluzione acquosa di zafferano condotta tra 200 e 600 nm.
Osservando lo spettro di assorbimento riportato sopra si vede che il valore di assorbanza relativa alla crocina effettuata a 442,87 nm è pari a 1,1723.
Mediante la formula (1) riportata sopra è possibile calcolare l' assorbanza specifica a ll'1% della crocina che risulta essere di un valore pari a 234 ( A 1% = 1,1723 / 0,005 = 234.).
Tale valore di 234 in base a QUESTA TABELLA merceologica farebbe rientrare tale zafferano in esame nella 1° categoria. Tale operazione va ripetuta anche per gli altri due principi chimici cioè la picrocrocina e il safranale effettuando ulteriori misure dell'assorbanza a 257 e 330 nm.
Se i tre valori risultanti rientrano tutti nella prima riga della tabella possiamo affermare che lo zafferano è di prima categoria (alta qualità).
Qui sotto vi è un video che illustra le varie fasi della coltivazione e di elaborazione dello zafferano.
Per visionare un video che illustra come viene coltivato, raccolto e trattato lo zafferano prima di essere utilizzato in cucina cliccare QUI.
Per scaricare la metodica completa di questa analisi cliccare su QUESTO LINK
Approfondimenti sulla chimica dello zafferano si possono trovare QUI












Nessun commento:
Posta un commento